Какие генетические тесты может сделать пациент с БАС и его родные? Имеет ли смысл проходить тест здоровому человеку? Что тест может сказать о наследовании заболевания, какие ограничения имеет? Об этом на Пятой общероссийской пациентской конференции по БАС, организованной фондом «Живи сейчас», рассказал Федор Коновалов, кандидат биологических наук, руководитель Лаборатории Клинической Биоинформатики (Москва). Публикуем статью на основе его доклада.
Генетический тест: за и против
Проводить или не проводить генетическое тестирование? Вопрос сложный. Многое зависит от того, для кого оно проводится.
Одно дело, когда к генетическому тестированию обращается пациент с БАС с целью уточнения диагноза и прогноза: зная причину болезни на молекулярном уровне, его лечащий врач лучше представляет, к какому мировому опыту ему следует обращаться, какую более конкретную информацию о болезни следует использовать или искать в литературе. Возможно, исследование может помочь при планировании в будущем лечения конкретной формы БАС: разработка терапии обычно основана на понимании молекулярного механизма, в частности для БАС, вызванного мутацией в С9orf72, в силу того, что эта мутация особым образом меняет процессы в клетке; ведутся определенные разработки патогенетической терапии в этой связи.
Другой случай – проверка наследования мутаций у членов семьи больного БАС.
Для того, чтобы оценить шансы на развитие болезни у здорового родственника, необходимо заранее знать конкретную мутацию, ответственную за БАС в данной семье.
Не имеет смысла искать «что угодно» и проводить широкое поисковое исследование, скажем, за 50 тысяч рублей каждому здоровому члену семьи: это не только нерационально, но и связано с некоторыми ограничениями для сообщения определенного подкласса результатов лабораториями. Оптимальный и логичный способ – сначала узнать, какая именно мутация (либо их комбинация при рецессивной форме) есть у больного, и уже после этого решать вопрос с тестированием родственников прицельно на это конкретное изменение в ДНК. Допустим, если у больного подтверждена мутация в гене С9orf72, то родственникам достаточно, в случае их обдуманного желания провериться, сдавать только тест на С9orf72; если у больного выявлена мутация SOD1, то родственниками сдается только тест на эту мутацию в гене SOD1. Лишнее сдавать не нужно!
Кроме того, вопрос с тестированием встает при планировании семьи – например, когда родители хотят гарантировано обеспечить рождение детей, которые в будущем не заболеют БАС. Если проводится преимплантационная генетическая диагностика (ПГД) эмбрионов, полученных в ходе ЭКО, то для этого также заранее необходимо знать конкретную мутацию, ответственную за БАС в данной семье: нельзя проводить ПГД просто «на болезнь».
Естественно, когда в семье у кого-то есть БАС, для родственников генетическое тестирование – это возможность узнать, проявится ли болезнь у них. И этот вопрос – проверять или нет – каждый взрослый человек решает для себя сам. Выбор может быть непростым. Очевидно, что если речь идет о здоровых людях, которые еще не знают, будет ли у них заболевание, нужно понимать, что возможен существенный и долговременный психологический эффект от результатов исследования – как для самого человека, так и для его родственников.

Мужья и жены людей с боковым амиотрофическим склерозом рассказывают о семье, любви и трудностях
Дело в том, что в отличие от почти всех других видов исследования, генетическое тестирование имеет одно очень важное свойство: его результаты, в определенном смысле, не отменить. Любое генетическое изменение, присутствующее в ДНК всех клеток организма, не может самопроизвольно из них исчезнуть. Скажем, МРТ делается в динамике, биохимический анализ – тоже, то есть сегодня эти исследования показывают одно, а через какой-то период – возможно, хотя бы теоретически, могут показать другое. «Генетика» же делается раз и навсегда. И о положительных результатах генетического теста не удастся забыть, как в фильме «Люди в черном» – нажать на кнопку, вспышка, и все, вы ничего не помните, – нет, это путь в один конец. Человек узнает нечто о себе, и дальше ему нужно быть действительно готовым с этим знанием жить, каким бы оно ни было.
Поэтому перед тем, как делать любое серьезное генетическое исследование – и я говорю не только про БАС – нужно десять раз подумать.
Ген, экзом и геном: в чем разница?
Современные методы анализа ДНК, которые обеспечили всплеск интереса к генетическим исследованиям в 2010-х годах, отличаются от классического анализа отдельных мутаций или генов – по объему получаемой информации.
Сейчас читаются уже не отдельные точки ДНК и даже не отдельные гены, читаются сразу десятки-сотни генов в одной реакции, в одном исследовании – за абсолютно разумные деньги. Можно прочитать за раз даже так называемый «экзом» – это белок-кодирующие участки всех двадцати тысяч генов человека, всех двадцати тысяч, – или его клинически значимую часть (около четырех-шести тысяч генов), так называемый «клинический экзом».
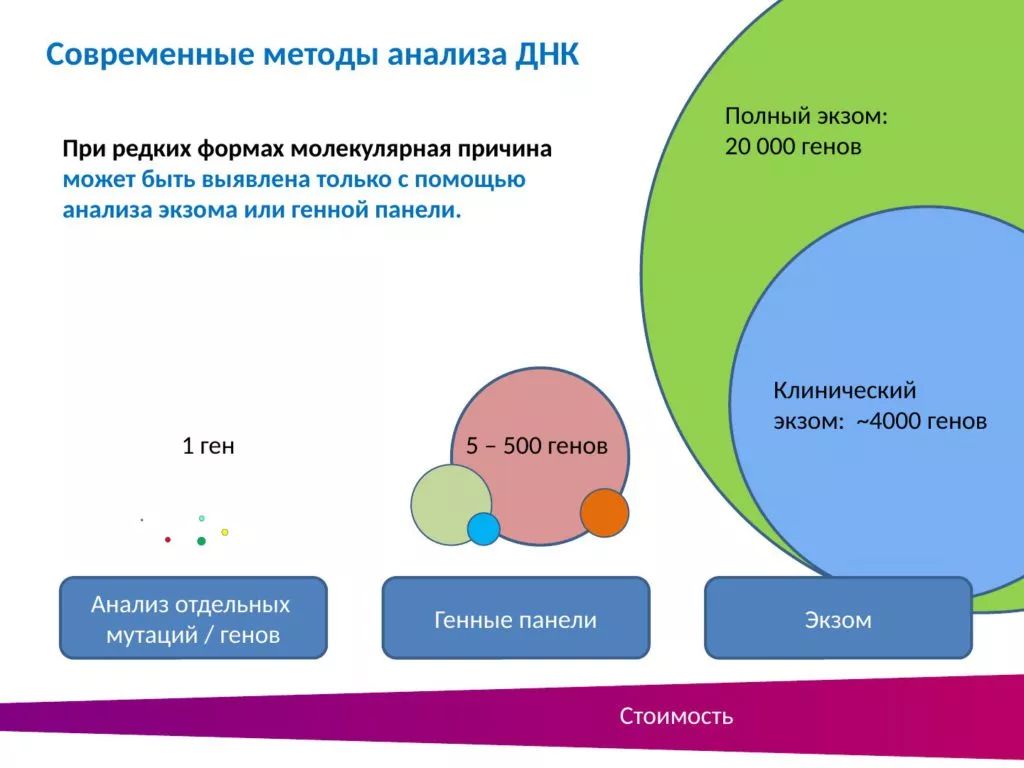
Для нас это важно потому, что при редких формах БАС – которые не связаны с генами SOD1 и С9orf72 – молекулярная причина может быть установлена только с использованием анализа экзома или генной панели. Понятно, что стоимость возрастает с ростом объема исследования, но не на порядки, а всего лишь в разы. И увеличение стоимости не пропорционально увеличению собственно объема исследования, и поэтому во многих случаях это оправдано.
Поисковые и подтверждающие тесты
Генетические тесты также можно разделить по другому принципу: на «поисковые» и «подтверждающие». Подтверждающие тесты – это когда мы знаем, на что смотрим, что ищем: какую конкретную мутацию будем сейчас выявлять (или, наоборот, опровергать ее наличие). Поисковые тесты – это когда мы ищем мутации, заранее не зная, какие из них нам встретятся, в определенных участках генома.

На этой схеме приведены все основные генетические тесты, используемые в диагностике молекулярных причин БАС.
Анализ повтора в гене С9orf72 - это особое подтверждающее исследование, потому что оно прицельно направлено на конкретный тип мутации. Оно не входит ни в одно другое исследование, даже в полногеномное секвенирование за 100 тысяч рублей, его всегда следует делать отдельно – это надо обязательно запомнить. Такой тест достаточно дешевый и делается во многих лабораториях.
Поиск мутаций в гене SOD1 – тоже недорогой тест. Он, по сути, комбинированный: одновременно и подтверждающий, и поисковый. Почему так? Дело в том, что это ген сравнительно маленький, поэтому поиск мутаций в нем делается классическим методом секвенирования по Сэнгеру – это эффективно; и поскольку тем же методом обычно выполняется и подтверждение мутаций, здесь эти процессы совмещены. Секвенирование по Сэнгеру имеет диагностический статус и делается в диагностических лабораториях.
Спорадические и наследственные случаи болезни
Встречаются так называемые семейные и спорадические случаи БАС. При семейном БАС заболевание уже проявлялось в семье: а если есть наследственная причина, то болезнь может проявиться и у родственников, несущих приводящую к заболеванию мутацию.
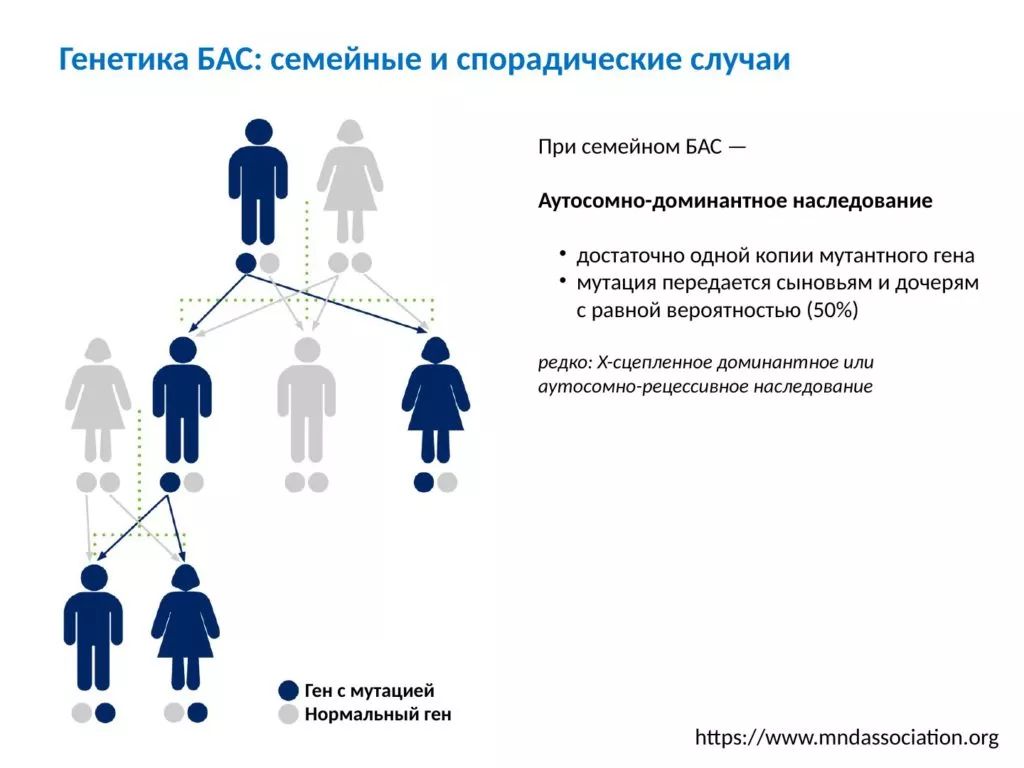
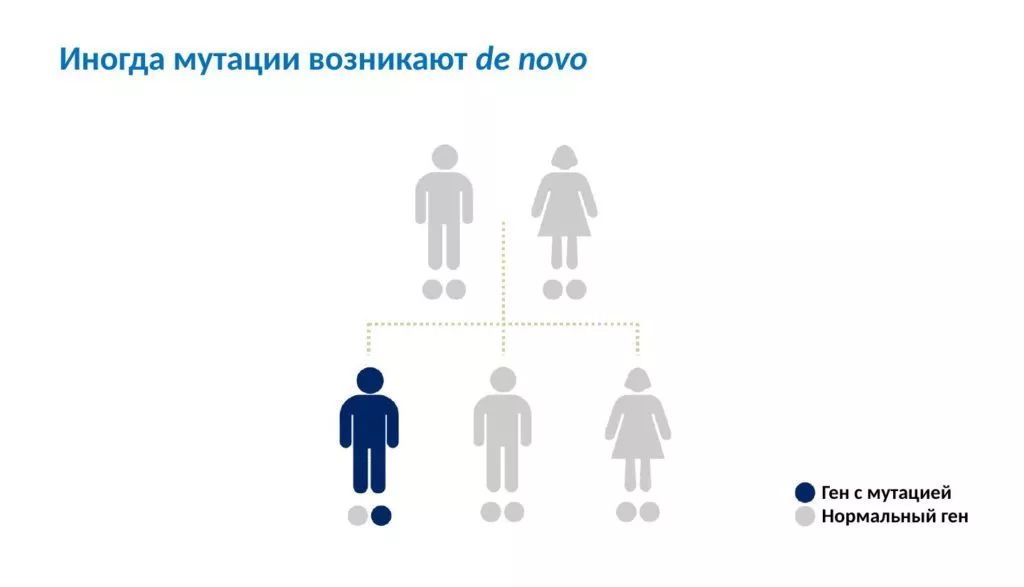
Спорадический случай – это когда заболевание выявляется в семейном анамнезе впервые. Однако причиной части таких случаев тоже может быть генетика – мутация, возникшая у пациента de novo, то есть впервые появившаяся в этой семье. Далее, раз возникнув, она может передаваться по наследству. В таких случаях за внешне спорадическим случаем скрывается, возможно, будущий семейный, если дети унаследуют именно мутантную копию гена от носителя мутации de novo.
Важно отметить, что, хотя нас среди спорадических случаев особенно интересуют именно те, где есть генетическая причина, все-таки это относительная редкость. Большая часть спорадических случаев, похоже, является истинно спорадическими, особенно если подтверждающие тесты на мутации в C9orf72 и SOD1 дали отрицательный результат.
Сами по себе мутации de novo – совсем не редкость. Более того, каждый из нас их несет – в среднем, у каждого человека в геноме можно найти около 80 уникальных отличий от геномов родителей.
Просто у большинства людей они не попадают в какие-либо функционально значимые участки генома, в том числе в гены, связанных с БАС: спонтанные мутации возникают где угодно, как будто стреляешь наугад, а размер генома делает вероятность «попадания» в конкретное место сравнительно низкой.

Каких-то особых причин для мутаций de novo нет. Конечно, бывают, скажем так, сильные мутагенные воздействия, например, при проживании в зоне сильного радиационного облучения. Но это, во-первых, крайне редко встречается, во-вторых, такие воздействия вызывают, в основном, более крупные перестройки генома на хромосомном уровне, которые не имеют отношения к нашей теме.
ДНК при делении клеток копируется: каждая клетка, прежде чем разойтись на две, должна в точности воспроизвести обе копии трех с лишним миллиардов «букв» генетического «текста». И этот процесс не идеален. Копирование таких огромных масштабов подвержено ошибкам, случайным ошибкам, для которых нет абсолютно никакой внешней причины. Поэтому удивителен не факт возникновения мутаций de novo, а скорее, наоборот: что их, с учетом числа делений клеток и огромного размера генома, все-таки сравнительно мало.
Какие исследования делать при БАС в первую очередь?
Два вышеперечисленных теста – анализ повтора в гене С9orf72 и поиск мутаций в гене SOD1 – имеет смысл делать как при семейном случае БАС, так и при спорадическом. В каком порядке проводить эти тесты – не имеет значения.
Если у больного клинически подтвержден диагноз бокового амиотрофического склероза, в любом случае нужно начинать с этих двух тестов, потому что вероятность найти что-то этими методами выше, чем при других исследованиях.

«Проще подоткнуть одеяло, чем поговорить с человеком»
Что нужно знать о переживаниях тяжелобольного и его родных, и как поддержать друг друга
Если эти тесты ничего не выявили, тогда можно перейти к большим поисковым кругам – генетическим панелям или экзомам. Ряд лабораторий, которые владеют современными методами секвенирования нового поколения, анализируют так называемые «генетические панели»: они могут называться «БАС», либо «Нейродегенеративные заболевания», и ассоциированные с БАС гены обычно должны туда входить. О том, какая конкретно панель подойдет для пациента с БАС, должны подсказать сами лаборатории. Если лаборатория затрудняется ответить вам на этот вопрос, то, наверное, ей не стоит доверять – ведь она должна знать, что предлагает.
Панели эффективны с точки зрения соотношения цены и выявляемости, однако ограничены известными генами: в них может не входить что-то открытое совсем недавно. Поэтому после панели, возможно, имеет смысл сделать секвенирование экзома, либо даже секвенирование генома, куда помимо кодирующих участков входит и все остальное: межгенные участки, интроны – весь геном человека целиком.
По цене анализ экзома не сильно отличается от панелей, а вот секвенирование генома отличается от экзома уже в два раза. И эта разница в цене не пропорциональна увеличению диагностической эффективности: геном повышает выявляемость относительно экзома буквально на несколько процентов, поэтому он интересен, скорее, для исследовательских целей. Тем не менее, именно секвенирование генома – последний рубеж, наиболее широкий вариант генетического исследования, который с недавних пор стал общедоступным.
Почему результаты надо перепроверять?
Все широкие поисковые методы основаны на технологии NGS (Next Generation Sequencing) – так называемое секвенирование нового поколения. Это тот самый современный прорывной генетический метод. Важно понимать, что его главное достоинство – именно широта охвата, однако точность не всегда столь же высока. Поэтому сегодня принято считать, что результаты, полученные с помощью NGS, нужно подтверждать. Это означает, что если найдена какая-то мутация с помощью панели, экзома, генома, и врач сказал: «Да, это похоже на причину заболевания», все равно нужно - даже чисто с технической, формальной точки зрения - эту конкретную мутацию подтверждать секвенированием по Сэнгеру. Этот тест недорогой, стоит примерно пять тысяч рублей на одного человека/одну мутацию, а если обследуются несколько членов семьи, лаборатории обычно дают некоторую скидку.
В медицине множество примеров такой перепроверки при получении важных положительных результатов: например, при первичном положительном результате анализа на ВИЧ делается дополнительное подтверждающее исследование, причем другим методом. Так же и здесь.
За рубежом, кстати, подтверждающее исследование иногда входит в стоимость исследования самого экзома, то есть результаты, которые вам выдаются, уже подтверждены по Сэнгеру. У нас эти тесты обычно стараются разделить, чтобы снизить стоимость исследования самого экзома. Но, повторимся, на всякий случай результаты поисковых тестов на основе NGS все-таки требуют подтверждения по Сэнгеру.
Как интерпретировать результат?
Каким может быть результат генетического теста? Вы не получите ответ в формате «положительный» или «отрицательный»: есть мутация или нет мутации. Все устроено несколько сложнее.
С одной стороны, есть классический положительный ответ, когда выявлена известная патогенная мутация: скажем, при анализе С9orf72 выявлено число повторов больше сотни. С одной стороны, здесь все понятно – нашли причину. Но не нужно из этого делать вывод, что у родственника больного БАС, несущего мутацию, обязательно разовьется это заболевание. Всегда нужно иметь в виду определенный запас на вариабельность проявления мутаций даже в одном и том же гене. Степень проявления заболевания у носителей одной и той же мутации, даже в пределах семьи, может быть разной (в генетике это называется «вариабельная экспрессивность»), вплоть до ненаступления заболевания при наличии мутации (термин «неполная пенетрантность»). Для разных генов и мутаций эти явления характерны в разной степени.
Вероятность развития БАС и прогноз зависят не только от наличия конкретной мутации (особенно это касается SOD1), потому что мутации в пределах одного гена иногда дают разный эффект. И хорошо, если этот эффект описан в литературе на большой когорте пациентов – можно хотя бы оценить вероятности. Чаще бывает, что большой статистики нет, особенно для редких генетических вариантов БАС.

Что такое «вариант с неопределенной значимостью»?
К сожалению, в генетике есть один момент: в поисковых исследованиях иногда выявляются мутации, которые ни кем ранее в мире не были описаны. Это не делает эти мутации «плохими», но мы их вынуждены называть ранее неописанными, либо термином «вариант с неопределенной значимостью». Что значит неопределенная значимость? На самом деле, эти мутации являются либо патогенными, либо доброкачественными (то есть вообще ни на что не влияющими): мы просто об этом не знаем на текущий момент. Информации об этом пока недостаточно, но тем не менее, по международным стандартам такие результаты рекомендовано все равно сообщать. Чтобы выяснить, патогенна такая мутация или нет, могут потребоваться дополнительные исследования.
Например, доктор может сказать, что нужен анализ ДНК родителей: если у родителей мутации нет, а у их ребенка с БАС – есть, тогда подтверждается статус de novo, что поднимает шансы мутации быть признанной в качестве патогенной. К сожалению (а может, и к счастью), с учетом возраста манифестации БАС, это исследование не всегда возможно, но тем не менее, иногда требуется.
Иногда для подтверждения патогенности мутации необходимы научные эксперименты, даже функциональный анализ мутации на клетках или животных моделях, который для своего проведения требует иногда работы целых крупных научных лабораторий, и даже в них не всегда возможен.
Другими словами, к сожалению, некоторые результаты таких поисковых исследований так и остаются в неопределенном статусе. Такова реальность! Поэтому, если вы получите вариант с неопределенной значимостью, это не повод делать выводы ни в плюс, ни в минус. Это важно. В любом случае нужна интерпретация результатов врачом, с учетом дополнительных данных.
И наконец, если тест показал отрицательные результаты, то есть мутации не выявлены, это, во-первых, ни в коем случае не исключает клинический диагноз. Если врач поставил диагноз БАС, отсутствие мутаций не означает, что БАС нет. Это важно понимать.
Почему результат может быть отрицательным?
Первая причина: конкретный случай БАС не является наследственным, он истинно спорадический, вообще не имеет генетической причины.
Вторая причина: мутация может быть в новом, еще не описанном гене. Все гены, которые сейчас открыты, когда-то были в таком статусе: например, еще несколько лет назад мутацию в NEK1 нельзя было сообщить и интерпретировать в рамках обычного обследования. По мере выхода новых научных статей и пополнения баз данных эта проблема постепенно решается.
И самый коварный момент. Бывает так, что мутация есть в геноме, но она не выявилась из-за технических ограничений метода. Особенно это касается широких поисковых исследований: секвенирование и панелей, и экзома, и даже генома испытывает сложности с детекцией некоторых нестандартных изменений на уровне ДНК. Это может быть критично. Например, иногда некоторые лаборатории чисто формально включали в панели ген С9orf72 и читали его белок-кодирующую часть обычным способом, подходящим для детекции нуклеотидных замен; но искомая мутация, экспансия триплета, в нем технически не могла быть выявлена при анализе панели или экзома. И поэтому, даже если у пациента она была, то при анализе это могло быть упущено. Следует знать технические ограничения для конкретного метода – поэтому тест на длину повтора в C9orf72 всегда делается отдельно.
Приходится констатировать, что отрицательный результат не только означает отсутствие заболевания, и, строго говоря, до конца не означает и отсутствие мутации.
Места, в которых выполняются описанные в статье генетические тесты, – это Медико-Генетический Научный Центр РАМН, лаборатория в Научном Центре Неврологии, а также ряд частных лабораторий, специализирующихся на секвенировании нового поколения: в частности, центры Genetico, «Геномед» и некоторые другие.
Получить второе мнение после секвенирования экзома или генома можно у нас, в Лаборатории Клинической Биоинформатики – мы специализируемся на анализе данных секвенирования и помогаем врачам в поиске причин наследственных заболеваний.
Будущее: найти причину БАС
Сегодня за ДНК-тестом при БАС, как правило, обращаются для уточнения диагноза, прогноза течения болезни, планирования семьи, и чтобы была возможность назначить более эффективную терапию для конкретной формы заболевания, в том числе, возможно, экспериментальную. Что касается родственников пациента с БАС – человек, безусловно, имеет право знать свой статус носительства. Однако результаты, которые можно получить, таковы, что это не будет полное знание: даже если мутация унаследована, не факт, что она проявится. В случае онкологии, например, выявив патогенную мутацию с высоким ассоциированным риском, можно хотя бы чаще проходить обследования, чтобы «поймать» некоторые виды рака на ранней стадии, если он возникнет, или даже сделав превентивное вмешательство. А что в случае с БАС?... Это вопрос очень тонкий с этической и психологической точек зрения, и тут каждый решает сам, хочет ли он пройти тестирование или ему это не нужно.
Пока исследователи лишь констатируют факт наличия или отсутствия мутации. Трудно сказать, когда ученым удастся узнать точный механизм возникновения бокового амиотрофического склероза. Такие механизмы будут постепенно открываться для каждого гена в отдельности, и они могут оказаться совсем разными. Для C9orf72 таких механизмов уже предложено как минимум четыре. Исследования ведутся чрезвычайно активно. Прогнозировать стопроцентное выявление всех генетических причин и молекулярных механизмов БАС по-прежнему очень сложно. Тем не менее, я думаю, что в ближайшие 10 лет многие механизмы станут описаны, а в ближайшие, может быть, 20-25 лет их будет известно уже большое количество.
Материал подготовлен с использованием гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Перепечатка материала в сети интернет возможна только при наличии активной гиперссылки на оригинал материала на сайте pro-palliativ.ru.
Запрещается перепечатка материалов сайта на ресурсах сети Интернет, предлагающих платные услуги.